| Strain Name |
NOD.CB17-PrkdcscidIl2rgtm1Bcgen/Bcgen |
Common Name |
B-NDG mice |
| Background |
NOD-scid |
Catalog number | 110586 |
|
Related Genes |
Male: Prkdc (-/-), Il2rg (X-/Y); Female: Prkdc (-/-), Il2rg (X-/X-) |
||
背景概述
B-NDG®小鼠(NOD.CB17-PrkdcscidIl2rgtm1Bcgen/Bcgen)是百奥赛图公司自主开发的,NOD-scid遗传背景的Il2rg基因敲除小鼠,缺乏成熟的T、B和NK细胞,是目前国际公认的免疫缺陷程度高、非常适合人源细胞或组织移植的工具小鼠。
• NOD(non-obese diabetes)遗传背景:自发I型糖尿病;其巨噬细胞对人源细胞吞噬作用弱;先天免疫系统,如补体系统和树突状细胞功能降低。
• Prkdc null(DNAPK,scid):Prkdc(protein kinase DNA-activated catalytic)基因突变,小鼠的功能性T和B细胞缺失,淋巴细胞减少,表现为细胞免疫和体液免疫的重度联合免疫缺陷(severe combined immunedeficiency, scid)。
• Il2rg null:Interleukin-2受体的gamma链(IL-2R γc,又称CD132)位于小鼠X染色体上,是具有重要免疫功能的细胞因子IL2、IL-4、IL-7、IL-9、IL-15和IL-21的共同受体亚基,该基因敲除后的小鼠机体免疫功能严重降低,尤其是NK细胞的活性几乎丧失。
B-NDG®小鼠:综合了NOD-scid-Il2rg null背景特征,具有重度免疫缺陷表型,无成熟T细胞、B细胞和功能性NK细胞,细胞因子信号传递能力缺失等。非常适合人造血干细胞及外周血单核细胞的移植和生长。
B-NDG 小鼠优势
• 世界公认的重度免疫缺陷小鼠
• 与NOD-scid小鼠相比寿命更长,平均长达1.5年
• 对人源细胞和组织几乎没有排斥反应
• 少量细胞即可成瘤,依赖于细胞系或细胞类型
• 无B淋巴细胞泄漏
主要应用领域
• 人源细胞或组织移植
• 肿瘤和肿瘤干细胞研究
• ES和iPS细胞研究
• 造血和免疫学研究
• 人类疾病感染模型研究
• 新的人源化动物模型研发
B-NDG商标申请
百奥赛图(北京)生物医药科技股份有限公司分别对“B-NDG”进行了第5类、第31类、第42类和第44类进行了商标申请。各字母代表含义:B-Biocytogen; N-NOD background; D- DNAPK(Prkdc) null; G- G: IL2rg knockout。
第5类:人用药;医用水蛭;医用生物标志物诊断试剂;医用或兽医用微生物培养物;医用营养食物;净化剂;兽医用制剂;杀虫剂;医用填料;兽医用干细胞(截止)
第31类:活动物;活家禽;活鱼;甲壳动物(活的);树木;谷(谷类);植物;植物种子;动物栖息用干草;饲料(截止)
第42类:质量控制;化学研究;生物学研究;临床试验;材料测试(截止)
第44类:医药咨询;医院;人工授精;饮食营养指导;动物养殖;兽医辅助;人工授精(替动物);试管授精(替动物);卫生设备出租;试管授精(截止)

小鼠饲养注意事项
1. 饲养环境
- 百奥赛图的B-NDG小鼠是在严格的SPF级的隔离包或IVC中饲养繁殖。
- 但是鉴于动物房管理及微生物水平参差不齐,我们不能保证小鼠在所有IVC环境下一定都能健康生长。我们建议一定要尽量提高现有IVC动物房的洁净标准,如饲养笼具和垫料要经过高压灭菌处理,饲料进行60Co辐照灭菌处理,并保证定期更换笼盒,所有和小鼠相关的操作都要在超净操作台进行等,越干净的环境越能保证小鼠更长时间的健康生长!
2. 饲料
- 百奥赛图B-NDG小鼠生产繁殖使用的是协同生物的“辐照灭菌实验用转基因鼠饲料( 产品货号:XTI01ZJ-012)”,可以保证小鼠的健康生长和繁殖。
3. 饮水
- 百奥赛图的动物饮用水采用的是高压灭菌的酸化水(用HCl调节pH至2.5-3.0之后再高压灭菌),可有效预防假单胞菌和金黄色葡萄球菌的污染。
4. 垫料
- B-NDG小鼠属于免疫缺陷型小鼠,我们推荐使用刨花垫料或者玉米芯垫料,同时在笼盒中放置絮窝纸。垫料同样需要经过高压或者60Co辐照灭菌处理,刨花垫料每周更换一次,玉米芯垫料每两周更换一次。需要在超净工作台内更换垫料,而且需要使用消毒过的镊子转移小鼠到新的笼盒,避免用手直接接触小鼠。
5. 环境
- 在饲养过程中,保证足够的光照强度(太强或太弱都不行)和光照时间,一般采用12小时光照,12小时黑暗的光照模式。
- 环境温度应保持在20-26℃,日温差不超过4℃。
- 环境湿度应保持40-70%。
- 饲养笼盒材质要无毒无害,便于清洁和消毒。

6. 运输
- 百奥赛图目前采用陆运和空运两种方式运输,运输箱为高压过的塑料运输箱,可以保证运输过程中小鼠的微生物级别。运输箱内会准备好饲料、垫料、凝胶果冻等,保证小鼠的正常饮食和活动。
- 运输过程中我们会尽量保证轻拿轻放,避免小鼠在途中颠簸,但小鼠在运输过程中依然可能会有应激反应,加速小鼠的代谢和排泄。尽管我们在运输箱内添加了果冻供动物采食,小鼠还是有可能出现不同程度的脱水状况导致体重减轻。一般运输所造成的小鼠体重消耗为10%左右,如果运输时间长、路途远、装箱密度大,体重消耗可能达到15%。不过这种情况一般经过7-15天的适应性饲养(建议使用科奥协力生长繁殖饲料),大部分小鼠可恢复体重(不能保证100%同步恢复)。
7. 适应性饲养
- 进行适应性饲养的必要性:所谓适应性饲养,是指实验动物由繁殖地转移到实验动物房以后,在实验之前,为了使之适应新环境而饲养几天的过程。因为在运输、转移过程中,动物会有应激反应,为消除应激反应,一般需要进行为期7-15天的适应性饲养。
- 适应性饲养过程中需要注意的问题:根据以上饲养条件配置动物的饲养条件,收到动物后密切观察其外观、毛发、排泄物、活动情况,这是考察动物是否有疾病的外在表现。注意与实验室原有饲养的动物隔开一定的距离,其它动物的声音、排泄物的氨味会对新来的动物有一定的影响,适应性饲养是保证实验成功的前提之一。
表型分析
小鼠生长曲线

图1. B-NDG小鼠生长曲线
雌雄小鼠各50只,小鼠3周龄断奶后(出生日期±3天)每周固定日期进行称重,数据收集共13周。
小鼠血清抗体检测

图2. B-NDG®小鼠血清抗体亚类检测
(A)空白对照及B-NDG小鼠OD值均在0.04左右,BALB/c小鼠OD值显著高于B-NDG 小鼠,可认为B-NDG 小鼠血清中无IgG和IgM存在。(B)空白对照孔OD450均在0.06左右,本底值低于0.1,说明捕获抗体、酶标抗体和BSA之间没有交叉反应。分别检测BALB/c小鼠和B-NDG 小鼠血清IgG1、IgG2a、IgG2b和IgG3,BALB/c小鼠体内存在IgG各亚类抗体,B-NDG小鼠血清中不存在IgG各亚类抗体(n=3)。
结果表明:B-NDG小鼠作为缺失T细胞、B细胞的重度免疫缺陷模式小鼠,体内不存在任何类型的Ig抗体。
T细胞、B细胞和NK细胞的检测


图3. B-NDG小鼠的T 、B和NK细胞的完全缺失
从 C57BL/6N、NOD-scid 和B-NDG小鼠(n=3,6 周龄,雌性)中分离血细胞,脾细胞,骨髓。对其进行流式细胞术分析,以评估白细胞亚群。 (A) 代表性流式图。 (B) FACS 分析结果,在 C57BL/6N 小鼠中可检测到 T 细胞、B 细胞和 NK 细胞,在NOD-scid小鼠中可检测到NK细胞,但在 B-NDG 小鼠中均未检测到。
髓系细胞免疫分型


图4. B-NDG小鼠的髓系细胞分型
从 C57BL/6N、NOD-scid 和B-NDG小鼠(n=3,6 周龄,雌性)中分离血细胞,脾细胞,骨髓。对其进行流式细胞术分析,以评估髓系细胞亚群。结果显示,在B-NDG小鼠中可检测到髓系细胞。
Granulocytes :mCD45+mGr-1+, DCs:mCD45+mCD11c+, Macrophages:mCD45+mCD11b+mF4/80+,
Monocytes: mCD45+mCD11b+mF4/80-.
B-NDG脾脏组织学检测

图5.小鼠脾脏组织切片及HE染色
取C57BL/6、NOD-scid 和 B-NDG小鼠(n = 3,9 周龄,雌性)脾脏,对脾脏样本进行组织切片及HE染色。结果显示:C57BL/6 小鼠脾脏结构正常,滤泡清晰。NOD-scid 小鼠的脾脏显示白髓发育不全。B-NDG 小鼠的脾脏显示滤泡结构完全丧失。
B-NDG脾脏组织学检测

图6.小鼠脾脏组织切片及IHC染色
取C57BL/6、NOD-scid 和 B-NDG小鼠(n = 3,9 周龄,雌性)脾脏,对脾脏样本进行组织切片及IHC染色。结果显示:C57BL/6 小鼠脾脏 CD3ε 和 CD19 表达正常(棕色),小鼠 B-NDG 小鼠无 CD3ε 和 CD19 表达。
血常规检测


图 7. B-NDG 小鼠的全血细胞计数 (CBC)
试验采集 B-NDG 小鼠(n = 6,6 周龄,雌)的血液并分析 CBC。数值表示为平均值±SEM。
血生化检测


图 8. B-NDG 小鼠血液生化检测结果 。
采集 B-NDG 小鼠(n = 6,6 周龄,雌)的血清,并分析 ALT、AST、CHOL、CR、GLU、TRIG 和 UREA 的水平。数值表示为平均值±SEM。仪器:Thermo Fisher scientific#Indiko
CDX 肿瘤模型及药效评价
CDX 淋巴癌转移模型

图9. Raji淋巴肿瘤细胞在B-NDG®小鼠上能更有效地建立系统和转移肿瘤模型。
对B-NDG®、NOD-scid、BALB/c Nude小鼠通过尾静脉注射相同数量(5 × 105)的Raji细胞,后在不同的时间点记录并分析小鼠的如下各种指标。
A.细胞接种后记录小鼠生存情况,绘制Kaplan-Merier生存曲线。
B.细胞接种后每周小鼠体重变化(g),并计算出相对于接种当天的相对体重。
C.小鼠外周血中人源细胞百分率变化。接种Raji细胞后,每周通过眼眶静脉丛采取100 μl全血,提取DNA,通过q-PCR技术检测小鼠外周血中人源细胞比率。
D.接种Raji细胞后小鼠肝脏对比。接种后待小鼠体重下降超过30%后执行安乐死并解剖脏器,进行拍照。
E.接种Raji细胞后小鼠脏器免疫组化染色。一抗为鼠抗人线粒体膜蛋白抗体。
B-NDG®小鼠 CDX淋巴癌体内药效实验


图10. 基于B-NDG小鼠的Raji淋巴癌转移模型及药效评价
对B-NDG®小鼠通过尾静脉注射相同数量(5×105)的Raji-Fluc细胞,并在第3天以及第10天尾静脉注射相同计量的抗体X,之后在不同的时间点成像观察肿瘤生长状况。A.不同时间点对小鼠成像观察肿瘤生长情况;B.不同分组小鼠成像下肿瘤细胞荧光强度曲线。结果表明,早期治疗(Raji细胞移植3天,10天)的治疗效果显著,晚期治疗(Raji细胞移植10天)的治疗效果明显变差,基本无效。
B-NDG®小鼠进行抗人CD47抗体药效验证实验
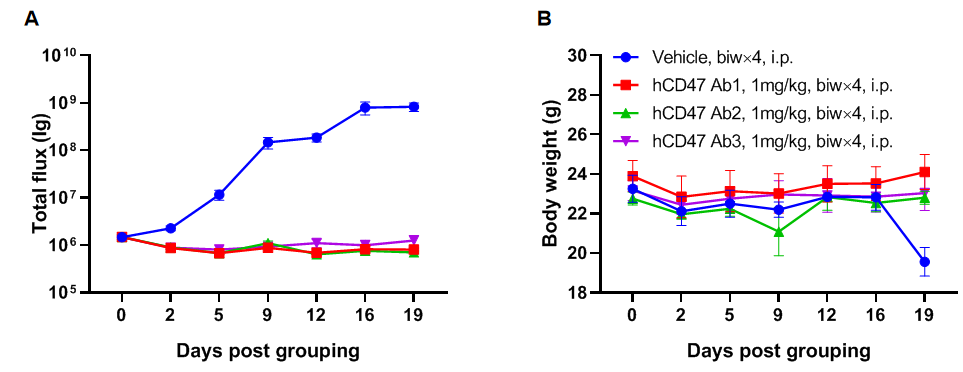
图11.利用B-NDG®小鼠进行抗人CD47抗体药效验证实验
使用B-NDG小鼠建立Raji淋巴瘤模型并验证抗人CD47抗体的药效。在B-NDG小鼠中通过尾静脉注射B-luc-GFP Raji细胞(5×105),利用小动物活体光学成像系统(IVIS)观察肿瘤的生长状况。待肿瘤的荧光强度达到1E6左右时将动物入组至对照组和治疗组(n=6)。(A) 小鼠肿瘤的荧光强度曲线;(B) 小鼠的体重变化。 结果显示:3种抗人CD47抗体都能显著性抑制肿瘤的生长。说明B-NDG小鼠可以用来建立肿瘤模型并验证抗体的体内药效。数值表示为平均值±SEM。
B-NDG®小鼠进行CAR-T药效验证实验
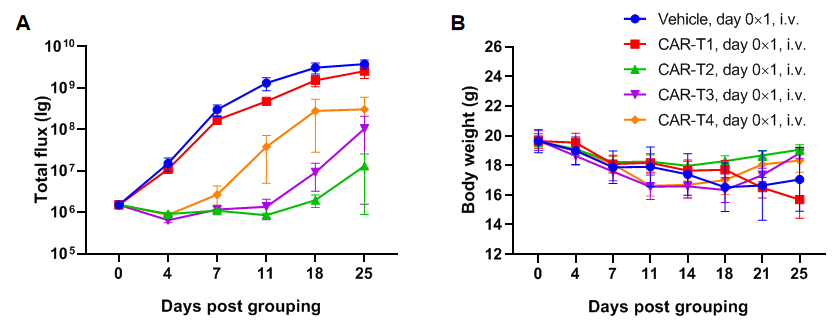
图 12.CAR-T 疗法在 B-NDG 小鼠中的抗肿瘤活性。
使用B-NDG小鼠建立Raji淋巴瘤模型并验证CAR-T的药效。在B-NDG小鼠中通过尾静脉注射B-luc-GFP Raji细胞(5×105),利用小动物活体光学成像系统(IVIS)观察肿瘤的生长状况。待肿瘤的荧光强度达到1E6左右时将动物入组至对照组和治疗组(n=6),注射的CAR-T细胞数为1E7。(A)小鼠肿瘤的荧光强度曲线;(B)小鼠的体重变化。结果显示:4 种CAR-T细胞在B-NDG 小鼠构建的肿瘤模型中表现出不同的肿瘤抑制活性。说明B-NDG小鼠可以用来建立肿瘤模型并验证CAR-T的药效。数值表示为平均值±SEM。
使用B-NDG小鼠建立CDX模型并验证ADC药物的药效
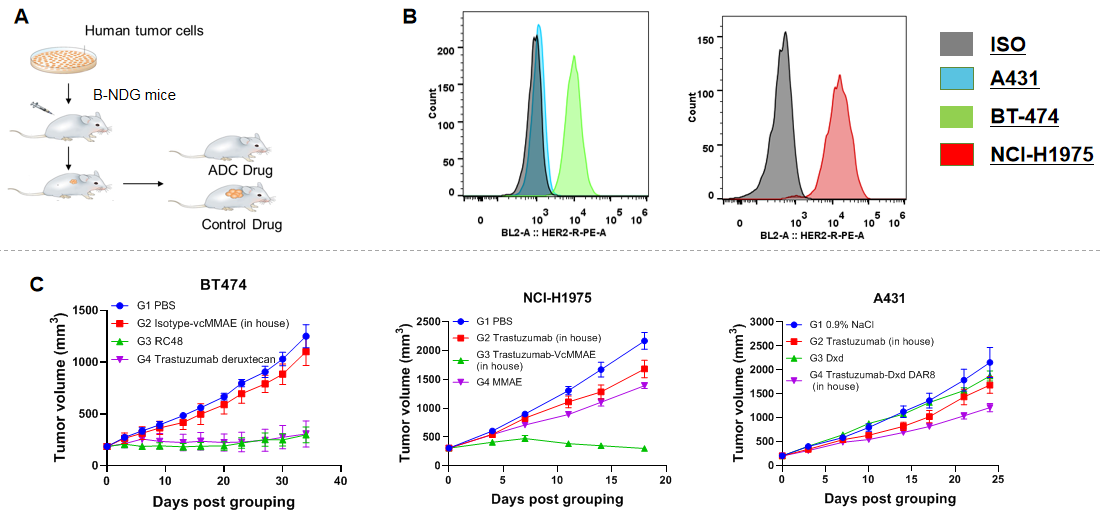
比较3种不同Her2表达量的细胞系在B-NDG小鼠中建立CDX模型后验证靶向Her2的ADC药效的差异。分别将A431、BT-474、NCI-H1975细胞接种到B-NDG小鼠的皮下,待肿瘤体积长到合适大小开始分组并静脉给药,使用的药物来源为内部合成(in house)或直接购买商品化的药物(药物名称后没有标记“in house”)。(A) CDX模型构建及给药策略示意图;(B) 体外培养的A431、BT-474、NCI-H1975细胞中人Her2的表达水平检测;(C) 3种细胞系分别构建CDX模型并验证靶向Her2的ADC药物的药效。结果显示:BT-474和NCI-H1975细胞中高表达Her2,而A431细胞中的Her2表达量非常低。靶向Her2的ADC药物能显著性地抑制高表达Her2的细胞系(BT-474、NCI-H1975)构建的CDX模型中肿瘤的生长,但对低表达Her2的肿瘤(A431)抑制作用比较弱。说明通过选择靶点表达量高的细胞系在B-NDG小鼠中构建CDX模型可以成功用于验证ADC药物的体内药效。数值表示为平均值±SEM。
使用B-NDG小鼠建立胰腺原位CDX模型并验证ADC的药效
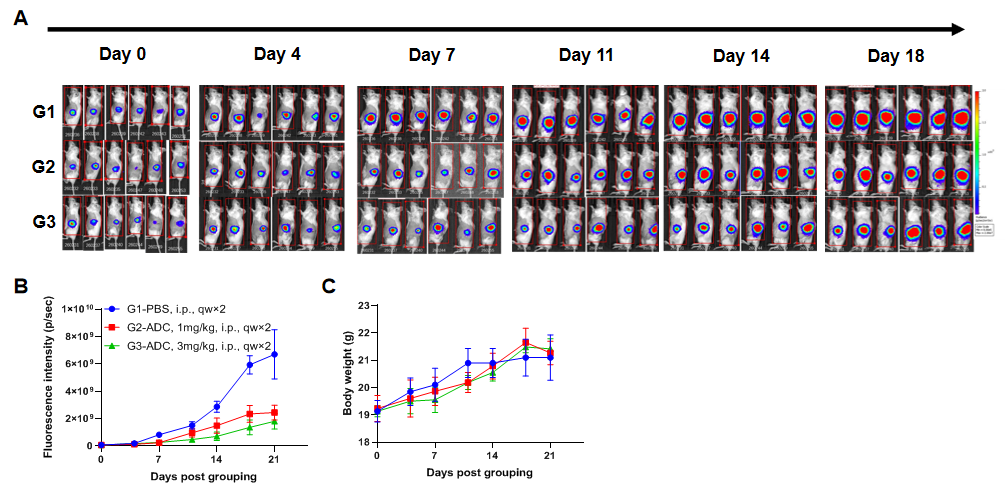
使用B-NDG小鼠建立胰腺原位MIA Paca-2胰腺癌模型并验证ADC药的药效。将B-luc MIA Paca-2细胞(1E5)移植到B-NDG小鼠的胰腺组织中(雌性,7周龄),利用小动物活体光学成像系统(IVIS)观察肿瘤的生长状况。待肿瘤的荧光强度达到7E7 p/sec 左右时将动物分组并分别腹腔注射两个剂量的ADC药物(n=6)。(A) 小鼠成像观察肿瘤的生长状况;(B) 小鼠肿瘤的荧光强度曲线;(C) 小鼠的体重变化。结果显示:ADC能显著性抑制在B-NDG小鼠构建的原位B-luc MIA Paca-2结肠癌模型中肿瘤的生长。说明B-NDG小鼠可以用来建立B-luc MIA Paca-2胰腺原位肿瘤模型并验证ADC的体内药效。数值表示为平均值±SEM。
在B-NDG小鼠中移植人PBMCs重建人T细胞
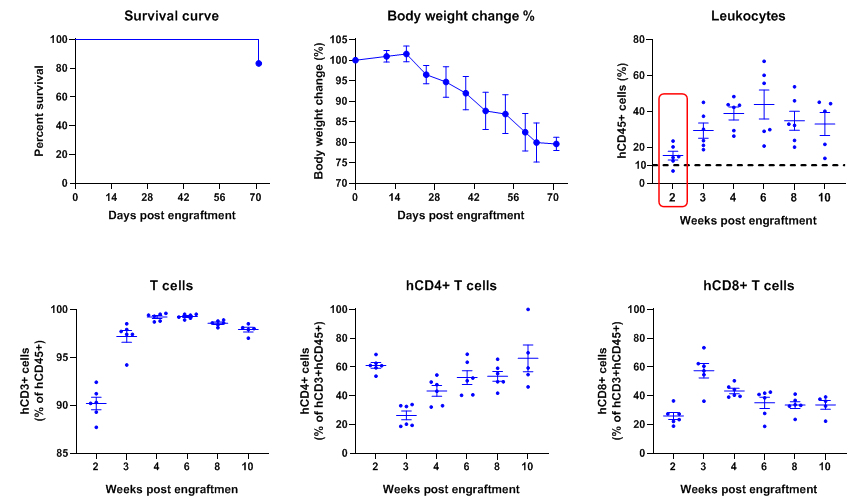
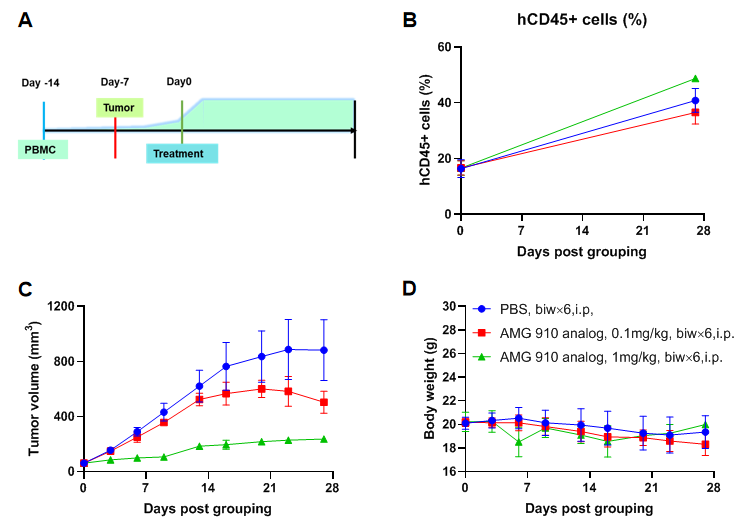
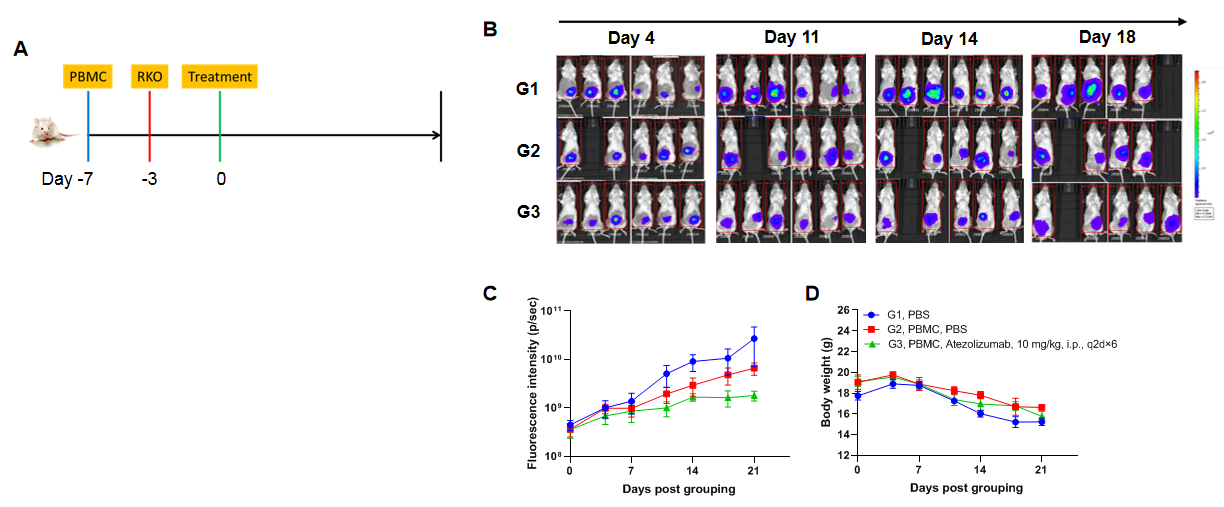
使用人PBMCs重建的B-NDG小鼠建立结肠原位CDX模型并验证抗体的药效
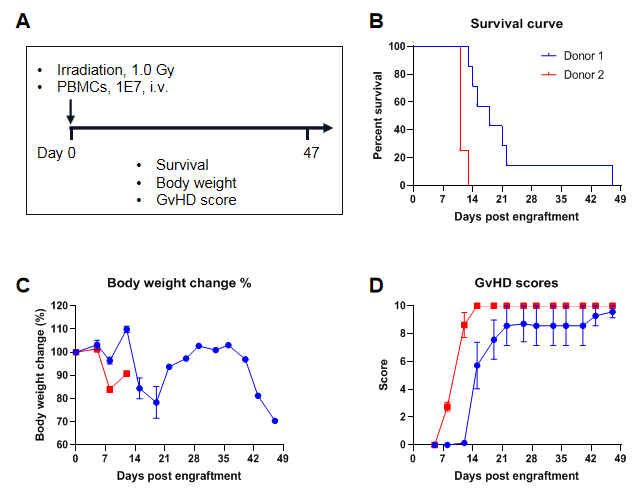
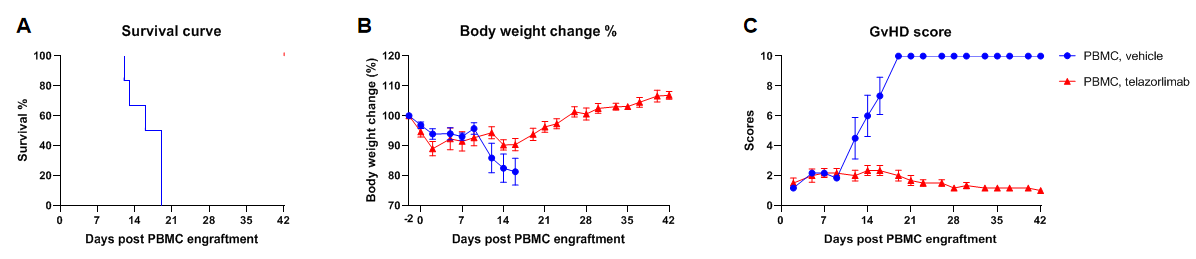
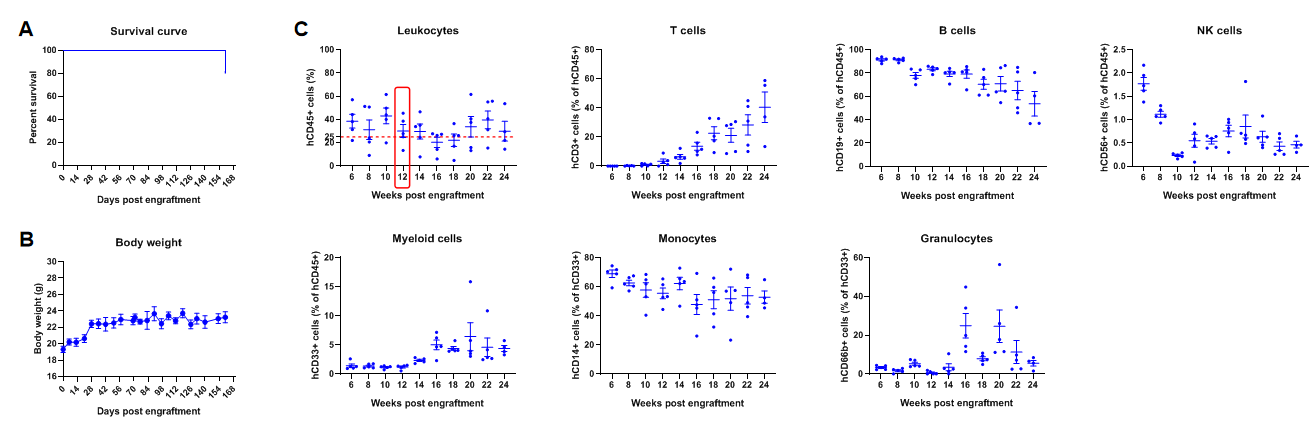
在B-NDG成体鼠中移植人造血干细胞(CD34+ HSCs)成功重建人的T、B细胞和少量NK细胞及髓系细胞。6周龄雌性B-NDG小鼠,经1.0 Gy的X射线辐照后,4-12小时内通过尾静脉注射人CD34+ HSCs(1.5E5)(n=5),取外周血使用流式细胞术检测人免疫细胞的重建水平。(A) 人CD34+ HSCs移植后小鼠的生存曲线; (B)小鼠的体重变化; (C) 各类人免疫细胞的重建比例。结果显示:人CD34+ HSCs移植22周前未发现有小鼠死亡,重建160天有一只小鼠死亡;小鼠体重持续升高。人CD45+细胞的比例在移植6周时已超过25%,移植24周时仍能维持在25%左右;人T细胞的比例在重建10周时开始持续升高;人B细胞的比例在重建6周时的比例达90%以上,8周后持续下降;NK细胞的比例在重建后维持在0.5%-2%之间;髓系细胞的比例在重建后的平均值维持在1%-6%之间;单核细胞占髓系细胞的比例在重建后升高,最高比例达到70%左右,后续一直维持在50%以上;中性粒细胞占髓系细胞的比例在重建后的平均值维持在3%-20%之间。移植不同donor来源的人CD34+ HSCs、不同的辐照仪及辐照剂量会导致重建水平稍有差异,但重建水平的变化趋势类似。注:B-NDG小鼠中人CD34+ HSCs重建成功的标准:重建12周时外周血中hCD45+细胞的比例≥25%。
在B-NDG小鼠中移植人CD34+ HSCs重建人免疫系统(新生鼠)
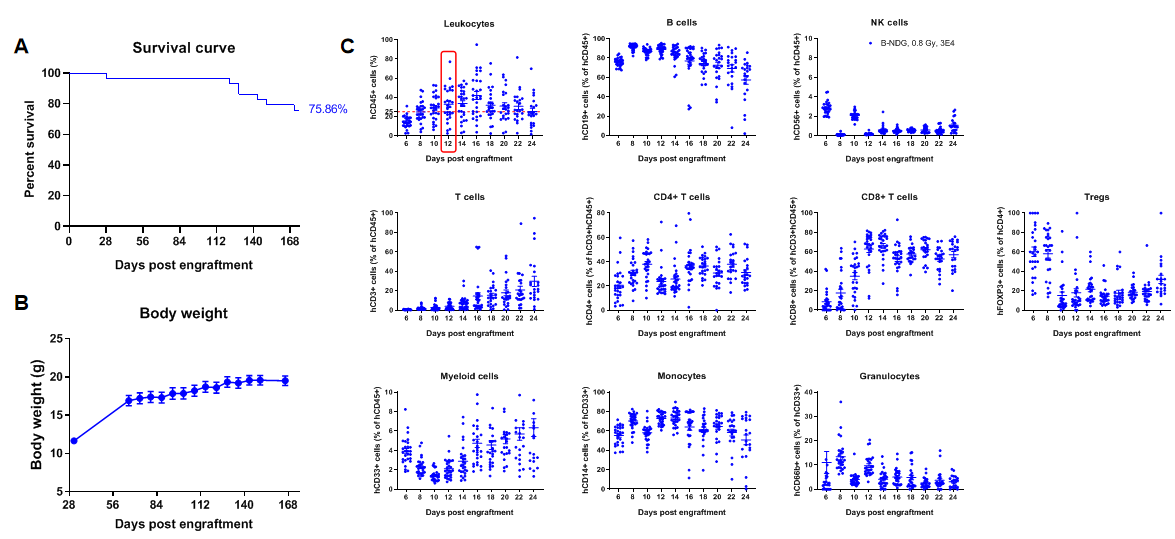
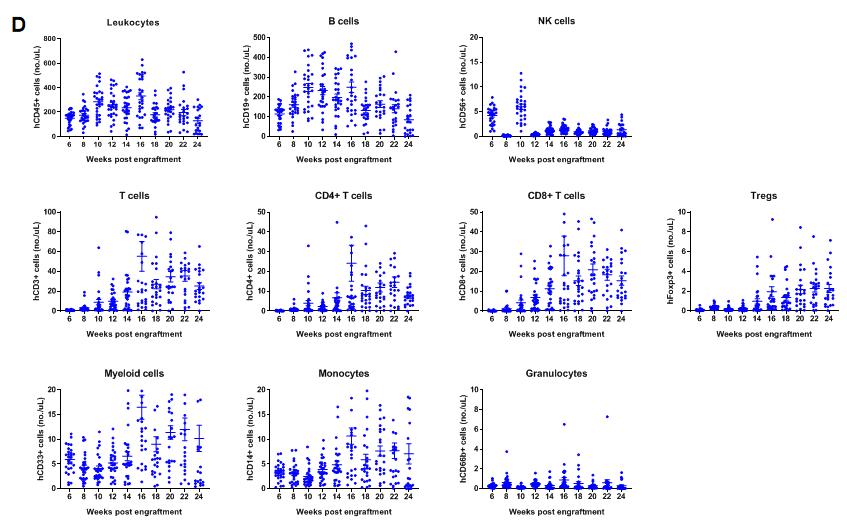
在B-NDG新生鼠中移植人造血干细胞(CD34+ HSCs)成功重建人的T、B细胞和少量NK细胞及髓系细胞。出生24-48小时的未区分性别的B-NDG新生鼠,经0.8 Gy的X射线辐照,4-12小时内通过面部的颞静脉注射人CD34+ HSCs(3E4)(n=28),取外周血使用流式细胞术检测人免疫细胞的重建水平。(A) 人CD34+ HSCs移植后小鼠的生存曲线;(B)小鼠的体重变化;(C) 各类人免疫细胞的重建比例;(D) 各类人免疫细胞的重建数量。结果显示:小鼠从重建17周开始出现死亡,体重持续增长。人CD45+细胞的比例从重建8周开始≥25%,但有明显的个体差异;人T细胞的比例在重建10周时开始持续升高,CD4+ T细胞、CD8+ T细胞和Treg细胞都有一定比例的重建;人B细胞的比例在重建6周时已达到70%以上,8周达到最高值后持续缓慢下降;NK细胞的比例在重建12周后处于1%以下;髓系细胞的比例在重建后先降低,12周开始持续升高,维持在1%-10%之间;单核细胞占髓系细胞的比例在重建后升高,最高比例达到80%左右,后续一直维持在40%-80%之间;粒细胞占髓系细胞的比例在3%-13%之间。从重建的人免疫细胞数量上看,人CD45+细胞、B细胞、总T细胞、CD4+T细胞、CD8+T细胞、Treg细胞、总髓系细胞和单核细胞都有一定数量的重建,人NK细胞和粒细胞数量很少。移植不同donor来源的人CD34+ HSCs、不同的辐照仪及辐照剂量会导致重建水平有差异,但重建趋势类似。注:B-NDG小鼠中人CD34+ HSCs重建成功的标准:重建12周时外周血中hCD45+细胞的比例≥25%。






 +86-10-56967680
+86-10-56967680 info@bbctg.com.cn
info@bbctg.com.cn